Quali applicazioni ha la PGD?
Nell’ambito della diagnosi pre-impianto è possibile individuare due distinte applicazioni:
- Identificazione di specifiche anomalie genetiche in coppie a rischio di trasmissione di malattie Mendeliane (causate dal difetto di un singolo gene), ed in questo caso di parla di PGD-M, o patologie cromosomiche note (numeriche o strutturali, come le traslocazioni), ed in questo caso di parla di PGD-SR. La tecnica consente di escludere dal trasferimento in utero gli embrioni geneticamente/cromosomicamente anormali.
- Analisi dell’assetto cromosomico finalizzato all’identificazione di anomalie di tipo numerico (aneuploidie) dell’embrione, ed in questo caso di parla di PGD-A, (per es. la Sindrome di Down) in coppie con problemi di fertilità derivanti da età materna avanzata, poliabortività, ripetuti falliti impianti dopo fecondazione assistita, scarsa qualità spermatica. Tale diagnostica viene comunemente chiamata PGS (Pre-ImplantationGenetic Screening).
A chi è rivolta?
Per quel che riguarda le anomalie cromosomiche (indicazione 1 o PGD-SR) , le indicazioni più frequenti sono rappresentate dalle traslocazioni bilanciate, reciproche e Robertsoniane. E’ raccomandato effettuare la PGD-SR solo se l’alterazione genomica riscontrata, confermata a livello germinale, è stata provata essere causa di fenotipo patologico. Vanno dunque escluse dalla PGD-SR le coppie portatrici di varianti genomiche a significato benigno o incerto. Un’attenta valutazione va fatta per quelle anomalia genomiche a bassa o variabile penetranza (es. 1q21.1; 3q29; 15q11.2; 15q13.3; 16p11.2; 16p13.1; 22q11.2), per valutare il reale beneficio del riscorso ad una tecnica di PMA con PGD-SR per ottenere un concepito euploide. E’ da valutare se includere nella PGD-SR le coppie portatrici delle comuni inversioni pericentriche eterocromatiniche (1, 9, 16, Y), inv(2)(p11q13), inv(3)(p11-13q11-12), inv(5)(p13q13), inv(10)(p11.2q21.1), poichè il rischio di sbilanciamento a termine è trascurabile, mentre il rischio di sbilanciamento nelle prime fasi di sviluppo embrionale non è noto.
La PGD-A per l’identificazione di anomalie cromosomiche di tipo numerico (indicazione 2) è rivolta alle coppie in cui:
1) viene effettuata su quella coppia altro tipo di PGD (es. per malattia monogenica), al fine di ottimizzare la valutazione dell’embrione trasferendo un embrione non affetto da malattia genetica senza aneuploidie cromosomiche.
2) la donna ha una età materna avanzata (AMA) > 35 anni. Recenti pubblicazioni hanno auspicato l’effettuazione della PGD-A in tutte le coppie che effettuano una PMA, a prescindere dall’età del partner femminile. Come ampiamente riportato, infatti, anche le giovani donne che consideriamo di buona prognosi hanno una percentuale di embrioni aneuploidi variabile tra il 25 ed il 35%.
3) la coppia ha avuto ripetuti falliti impianti (RFI) in diversi cicli di PMA standard (≥3 trasferimenti con embrioni di buona qualità o ≥10 embrioni trasferiti in trasferimenti multipli). Si definisce RFI l’assenza di sacco gestazionale ecografico a 5 o più settimane dopo il trasferimento embrionario.
4) la coppia con cariotipo normale ha avuto ripetuti aborti spontanei del I trimestre (≥2aborti), non dovuti a cause “meccaniche” quali patologie dell’utero (es. fibromi, malformazioni congenite, etc.), o altri fattori (es. difetti della coagulazione, autoimmunità, etc.). E’ importante sottolineare che coppie con storia di poliabortività hanno elevata probabilità di concepire spontaneamente e arrivare a termine di gravidanza entro 12 mesi, per cui è opportuno valutare ogni singolo caso soprattutto in relazione all’età della donna e alla riserva ovarica residua.
5) il partner maschile presenta un fattore maschile grave (grave oligoastenoteratospermia, criptospermiao azoospermia non ostruttiva, che devono ricorrere al prelievo di spermatozoi dalle vie seminali mediante le tecniche microchirurgiche di MESA e TESE).
6) uno dei partner presenta un mosaicismo cromosomico (cariotipo anomalo dato dalla presenza di diverse linee cellulari a mosaico,)
7) uno dei partner, in particolare la donna, è stato sottoposto a cicli di chemio-radioterapia o ha avuto una esposizione lavorativa o ambientale comprovata a radiazioni ionizzanti o inquinanti chimici.
E’ possibile infatti verificare la normalità del cariotipo (assetto cromosomico) degli embrioni e di trasferire solo quelli con cromosomi normali, al fine di ottenere una gravidanza a termine nel più breve tempo possibile.
Cosa prevede un ciclo di PGD?
Fase 1
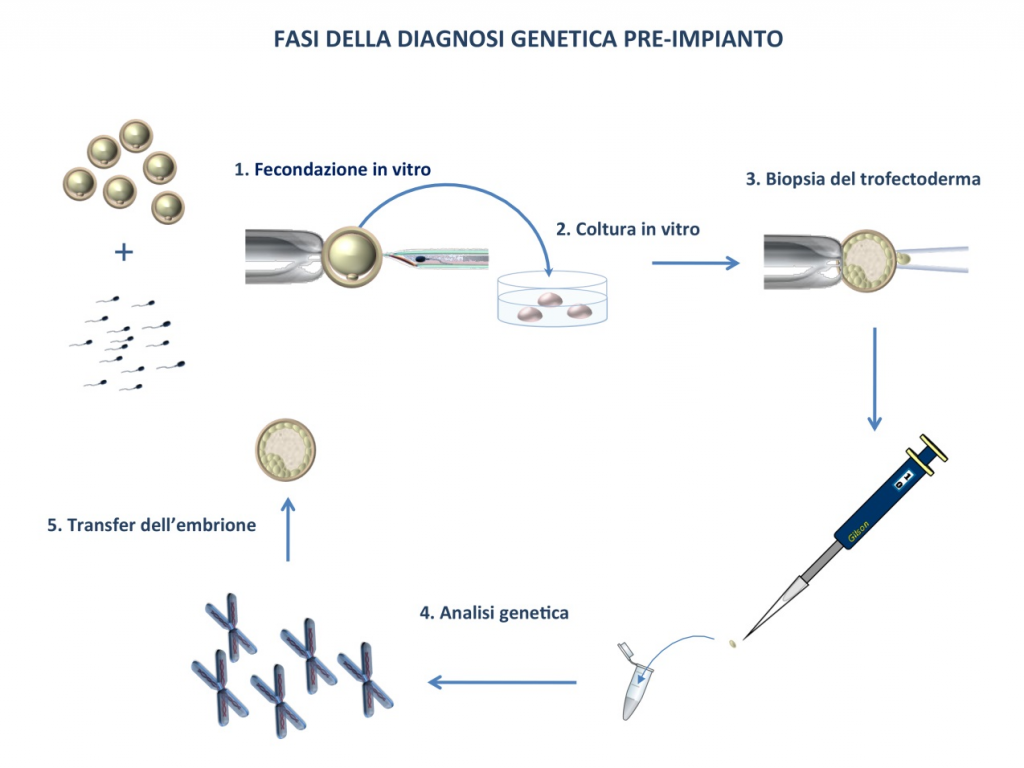 La coppia con malattia genetica che decide di accedere a tecniche di PGD viene inizialmente sottoposta a consulenza genetica, ginecologica e andrologica, nella quale viene spiegato alla coppia il percorso più opportuno da seguire per ottenere le maggiori probabilità di gravidanza di un bimbo non affetto dalla malattia genetica; per le indicazioni di PGS, vengono spiegati alla coppia i benefici ed i limiti della tecnica, al fine di ottimizzare le loro possibilità di gravidanza a termine. Inoltre, il ginecologo e l’andrologo, mediante opportune visite ed esami, stabiliscono l’idoneità della coppia alla fecondazione assistita. Questa fase dura almeno 30 giorni.
La coppia con malattia genetica che decide di accedere a tecniche di PGD viene inizialmente sottoposta a consulenza genetica, ginecologica e andrologica, nella quale viene spiegato alla coppia il percorso più opportuno da seguire per ottenere le maggiori probabilità di gravidanza di un bimbo non affetto dalla malattia genetica; per le indicazioni di PGS, vengono spiegati alla coppia i benefici ed i limiti della tecnica, al fine di ottimizzare le loro possibilità di gravidanza a termine. Inoltre, il ginecologo e l’andrologo, mediante opportune visite ed esami, stabiliscono l’idoneità della coppia alla fecondazione assistita. Questa fase dura almeno 30 giorni.
Fase 2
In caso di PGD per malattia monogenica, viene effettuata la messa appunto pre-concezionale con analisi del DNA della coppia (analisi diretta) ed, eventualmente, dei familiari (analisi indiretta). Questa fase ha una durata di circa 45-60 giorni. In caso di PGD-A o di anomalia cromosomica costituzionale bilanciata questa fase, in genere, non è necessaria.
Fase 3
La coppia viene sottoposta al trattamento di fecondazione assistita, durante il quale viene effettuata la biopsia dell’embrione (blastocisti) e la successiva analisi. Questa fase dura circa 10-15 giorni.
Fase 4
La coppia viene informata dal team (ginecologo, embriologo, genetista) dell’esito dell’analisi PGD e della qualità embrionaria, e si procede al transfer di uno o più embrioni.
Fonte http://www.periodofertile.it/gravidanza/la-diagnosi-genetica-pre-impianto-quando-si-puo-fare
Nessun commento:
Posta un commento